
Электричество окружает современного человека постоянно. Но даже на этом фоне удивительно, что напряжение присутствует в обычных вещах и продуктах (лимон, картофель и т.д.). С помощью них можно сделать простую батарейку в домашних условиях. Поскольку напряжение, ток и емкость изготовленной дома батарейки далеки от привычных нам источников питания, то использовать в реальной жизни такую батарейку смысла нет. Зато в качестве бытового физико-химического опыта для образовательных целей тема бесценна.
Немного теории
Устройство «на пальцах»

Предположим, что мы имеем емкость с кислотой с погруженными в нее цинковым и медным электродами (рис). Когда элемент выдает электрический ток через внешнюю цепь, цинк на поверхности цинкового электрода растворяется в растворе. Атомы цинка растворяются в электролите как электрически заряженные ионы (Zn2+), оставляя в металле 2 отрицательно заряженных электрона (e—)
Эта реакция называется окислением.
Пока цинк попадает в электролит, два положительно заряженных иона водорода (H+) из электролита объединяются с двумя электронами на поверхности медного электрода и образуют молекулу водорода (H2)
Эта реакция называется восстановлением.
Электроны, используемые на медном электроде для образования молекул водорода, передаются от цинкового электрода через внешний провод, соединяющий медный и цинковый электроды. Молекулы водорода, образующиеся на поверхности меди в результате реакции восстановления выделяются в виде газообразного водорода.
Об электролите
Напряжение на ячейке зависит от кислотности электролита, измеряемой по его pH. Уменьшение кислотности (увеличение pH) вызывает падение напряжения. Используемая кислота не влияет на напряжение, кроме как через значение pH. Это не так для сильнокислых электролитов (pH <3,4), когда цинковый электрод растворяется в электролите, даже при разомкнутой цепи. Две перечисленные выше окислительно-восстановительные реакции происходят только тогда, когда электрический заряд может переноситься через внешнюю цепь.
Об электродах
Из химии: ряд напряжений металлов используется на практике для относительной оценки химической активности металлов в реакциях с водными растворами солей и кислот и для оценки катодных и анодных процессов при электролизе. Восстановительная активность металлов (свойство отдавать электроны) уменьшается, а окислительная способность их катионов (свойство присоединять электроны) увеличивается в указанном ряду слева направо. Металлы, стоящие левее, являются более сильными восстановителями, чем металлы, расположенные правее: они вытесняют последние из растворов солей. Например, взаимодействие Zn + Cu2+ → Zn2+ + Cu возможно только в прямом направлении. Цинк вытесняет медь из водного раствора её соли. При этом цинковая пластинка растворяется, а металлическая медь выделяется из раствора.
Наиболее распространённые металлы расположены в ряду напряжений в следующей последовательности: Li, К, Ca, Na, Mg, Al, Mn, Zn, Fe, Co, Ni, Sn, Pb, (H2), Cu, Hg, Ag, Au.
Итого, чем дальше в этом ряду находятся металлы друг от друга, тем большее напряжение возникает между ними.
Теоретические выводы
- Получается, что энергия исходит не от лимона или картофеля, а от химического изменения цинка, когда он растворяется в кислоте.
- Чем выше кислотность (меньше pH) электролита (но до pH <3,4), тем выше напряжение
- Чем дальше в ряду напряжения металлов находятся друг от друга электроды, тем выше напряжение
- Между одинаковыми электродами напряжение должно быть 0
- О значимой силе тока в подобных экспериментах говорить не приходится. Она, конечно, прямо пропорциональна площади электродов, но площадь эта такова, что для получения аналога среднестатистического автомобильного аккумулятора потребовалось бы несколько миллионов ячеек из лимонов.
Можно приступать в проверке.
Батарейка из лимона или картофеля
Для того чтобы сделать батарейку из фрукта и подручных материалов, понадобятся следующие компоненты:
- лимон или картофель;
- стальной (цинковый, алюминиевый) предмет;
- медный предмет;
- два изолированных провода.
Прежде чем приступить к созданию простой батарейки, необходимо зачистить стальной и медный предметы. Это можно сделать наждачной бумагой.

Совет! В качестве стального предмета удобно использовать гвозди. В качестве медного — медную монетку или проволоку. Полоску цинка можно попытаться аккуратно добыть из корпуса старой батарейки, но надо соблюдать предельную осторожность
Далее необходимо воткнуть их в лимон на расстоянии 3-2 см друг от друга. А к импровизированным контактам присоединить провода. Также их можно аккуратно воткнуть вплотную к контактам. Медный элемент будет выступать в качестве плюса, а стальной минуса.

Интересно! Вместо лимона также можно использовать яблоко. Но необходимо выбирать кислые плоды, так как это необходимо для реакции.

Самодельная батарейка на основе одного лимона или яблока может выдавать примерно 0.5-0.7 Вольт. Этого недостаточно для заряда простого мобильного или приемника. Если нужно напряжение от 3 до 5 Вольт, то вполне возможно это сделать. Нарастание происходит за счет увеличения количества плодов.

Батарейка из монет
Конструкцию из монет в качестве простейшего гальванического элемента также называют Вольтов столб. Для его изготовления понадобится:
- медные монеты (например, по 10 или 50 копеек);
- фольга;
- бумага;
- уксус или очень соленная вода.

Для красоты конструкции необходимо выбирать монеты одного номинала. Также перед экспериментом их ненадолго окунуть в уксус. Это устранит налет и загрязнения. После чего необходимо вырезать из бумаги и фольги элементы по форме монеток. Их количество должно быть на 2 меньше, чем монет.
Вольтов столб собирается так:
- Бумага смачивается в растворе уксуса или соленной воды и прикрепляется к монетке.
- Сверху на бумагу кладется круг из фольги.
- Далее кладется следующая монетка.
- Этапы повторяются пока не кончатся монеты в выбранном количестве.
- Конструкция должна получиться такой, чтобы с одного конца была монета (+) последним элементом, а с другого фольга (-).
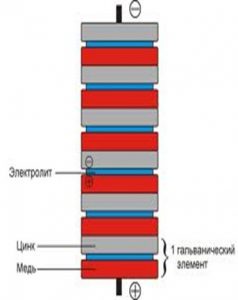
Чем больше монет будет задействовано в эксперименте, тем большее напряжение выдаст батарейка. Важно понимать, что после эксперимента монеты, возможно, не будут пригодны для использования. Элементы могут покрыться ржавчиной.
Батарейка в алюминиевой банке
Для создания батарейки своими руками в алюминиевой банке необходимо взять:
- алюминиевую банку (например, из под кока-колы);
- уголь от костра в виде крошки или пыли;
- свечка парафиновая;
- графитный стержень;
- соль и вода;
- пенопласт толщиной более 1 см.
Для начала необходимо отрезать у банки верхушку. После чего изготовить из пенопласта круг, подходящий ко дну банки. В круге необходимо проделать не сквозное отверстие для стержня. Пенопласт поместить на дно банки и воткнуть в него графит. Важно, чтобы стержень стоял ровно по центру банки. Пространство вокруг графитного стержня необходимо заполнить углем.
Важно! Стержень из графита не должен прикасаться к банке.
После чего остается сделать солевой раствор взяв 0.5 литра воды и 3 ст. ложки поваренной соли. Раствор размешивать до тех пор, пока кристаллы соли не растворятся, лучше это делать в теплой воде. Залить электролит в банку и запечатать ее воском. Важно чтобы стержень из графита выглядывал за банку.
Провода подключать к графитовому стержню (катод, плюс), и корпусу банки из алюминия (анод, минус). Для того, чтобы получить напряжение в 3 Вольт, необходимо последовательно подключить не менее 2 банок. Полученной батарейкой можно привезти в действие лампочку, калькулятор и часы. Также их можно заряжать.
Заключение
Все вышеописанные способы создания батареек не являются полноценными их заменителями. Но их вполне можно собирать ради интересного эксперимента для наглядной демонстрации работы и устройства гальванических элементов.




